ЛИДОКАИН
ЛИДОКАИН: инструкция по применению и отзывы
Клинико-фармакологическая группа
Действующее вещество
Форма выпуска, состав и упаковка
Раствор для инъекций прозрачный, бесцветный или почти бесцветный, без запаха.
| 1 мл | 1 амп. | |
| лидокаина гидрохлорид (в форме лидокаина гидрохлорида моногидрата 43 мг) | 20 мг | 40 мг |
Вспомогательные вещества: натрия хлорид для парентеральных форм — 12 мг, вода д/и — до 2 мл.
2 мл — ампулы с точкой разлома и с зеленым кодовым кольцом (5) — упаковки ячейковые контурные (20) — коробки картонные.
Фармакологическое действие
Лидокаин является короткодействующим местным анестетиком амидного типа. В основе его механизма действия лежит уменьшение проницаемости мембраны нейрона для ионов натрия. В результате этого снижается скорость деполяризации и повышается порог возбуждения, приводя к обратимому местному онемению. Лидокаин применяют в целях достижения проводниковой анестезии в различных участках тела и контроля аритмий. Обладает быстрым началом действия (около одной минуты после в/в введения и 15 мин после в/м), быстро распространяется в окружающие ткани. Действие продолжается 10-20 мин и около 60-90 мин после в/в и в/м введения соответственно.
Фармакокинетика
Лидокаин быстро абсорбируется из ЖКТ, однако вследствие эффекта «первого прохождения» через печень лишь небольшое его количество достигает системного кровотока. Системная абсорбция лидокаина определяется местом введения, дозой и его фармакологическим профилем. C max в крови достигается после межреберной блокады, далее (в порядке снижения концентрации), после введения в поясничное эпидуральное пространство, плечевое сплетение и подкожные ткани. Основным фактором, определяющим скорость абсорбции и концентрацию в крови, является общая введенная доза, независимо от участка введения. Имеется линейная зависимость между количеством введенного лидокаина и C max анестетика в крови.
Лидокаин связывается с белками плазмы, включая α 1 -кислый гликопротеин (АКГ) и альбумин. Степень связывания вариабельна, составляя приблизительно 66%. Плазменная концентрация АКГ у новорожденных низкая, поэтому у них отмечается относительно высокое содержание свободной биологически активной фракции лидокаина.
Лидокаин проникает через ГЭБ и плацентарный барьер, вероятно, посредством пассивной диффузии.
Лидокаин метаболизируется в печени, около 90% введенной дозы подвергается N-дезалкилированию с образованием моноэтилглицинксилидида (MEGX) и глицинксилидида (GX), оба вносят вклад в терапевтические и токсические эффекты лидокаина. Фармакологические и токсические эффекты MEGX и GX сопоставимы с таковыми лидокаина, но выражены слабее. GX обладает более длинным, чем лидокаин, Т 1/2 (около 10 ч) и может кумулировать при многократном введении.
Метаболиты, образующиеся в результате последующего метаболизма, выводятся с мочой.
Терминальный Т 1/2 лидокаина после в/в болюсного введения здоровым взрослым добровольцам составляет 1-2 ч. Терминальный Т 1/2 GX составляет около 10 ч, MEGX — 2 ч. Содержание неизмененного лидокаина в моче не превышает 10%
Фармакокинетика у особых групп пациентов
Вследствие быстрого метаболизма на фармакокинетику лидокаина могут оказывать влияние состояния, нарушающие функцию печени. У пациентов с нарушением функции печени Т 1/2 лидокаина может повышаться в 2 и более раз.
Нарушение функции почек не влияет на фармакокинетику лидокаина, но может привести к кумуляции его метаболитов.
У новорожденных отмечается низкая концентрация АКГ, поэтому связывание с белками плазмы может снижаться. В связи с потенциально высокой концентрацией свободной фракции применение лидокаина у новорожденных не рекомендуется.
Показания
Противопоказания
- AV-блокада III степени;
- гиповолемия;
- повышенная чувствительность к любому из компонентов препарата и к анестетикам амидного типа.
Дозировка
Режим дозирования следует подбирать в зависимости от реакции пациента и места введения. Препарат следует вводить в наименьшей концентрации и в наименьшей дозе, дающей требуемый эффект. Максимальная доза для взрослых не должна превышать 300 мг.
Объем раствора, подлежащий введению, зависит от размера анестезируемого участка. Если есть потребность во введении большего объема с низкой концентрацией, то стандартный раствор разводят физиологическим солевым раствором (0.9% раствор натрия хлорида). Разведение осуществляют непосредственно перед введением.
Детям, пожилым и ослабленным пациентам препарат вводят в меньших дозах, соответствующих их возрасту и физическому состоянию.
У взрослых и подростков в возрасте 12-18 лет однократная доза лидокаина не должна превышать 5 мг/кг при максимальной дозе 300 мг.
Дозы, рекомендуемые для взрослых :
| 10 мг/мл | 20 мг/мл | |
| Инфильтрационная анестезия | ||
| Малые вмешательства | 2-10 мл (20-100 мг) | — |
| Большие вмешательства | 10-20 мл (100-200 мг) | 5-10 мл (100-200 мг) |
| Проводниковая анестезия | 3-20 мл (30-200 мг) | 1.5-10 мл (30-200 мг) |
| Анестезия пальцев рук/ног | 2-4 мл (20-40 мг) | 2-4 мл (40-80 мг) |
| Эпидуральная, люмбальная | 25-30 мл (250-300 мг) | |
| Каудальная, грудная блокада | 20-30 мл (200-300 мг) | |
| Регионарная анестезия | не более 5 мл (50 мг) | не более 2.5 мл (50 мг) |
Опыт применения у детей в возрасте до 1 года ограничен. Максимальная доза у детей в возрасте 1-12 лет — не более 5 мг/кг массы тела 1% раствора.
Побочные действия
Нежелательные реакции описаны в соответствии с системно-органными классами MedDRA. Подобно другим местным анестетикам, нежелательные реакции на лидокаин редки и, как правило, обусловлены повышенной плазменной концентрацией вследствие случайного внутрисосудистого введения, превышения дозы или быстрой абсорбции из участков с обильным кровоснабжением, либо вследствие гиперчувствительности, идиосинкразии или сниженной переносимости препарата пациентом. Реакции системной токсичности, главным образом, проявляются со стороны ЦНС и/или сердечно-сосудистой системы.
Со стороны иммунной системы
Реакции гиперчувствительности (аллергические или анафилактоидные реакции, анафилактический шок) — см. также нарушения со стороны кожи и подкожных тканей. Кожная аллергическая проба на лидокаин считается ненадежной.
Со стороны нервной системы и психические расстройства
К неврологическим симптомам системной токсичности относятся головокружение, нервозность, тремор, парестезия вокруг рта, онемение языка, сонливость, судороги, кома.
Реакции со стороны нервной системы могут проявляться ее возбуждением или угнетением. Признаки стимуляции ЦНС могут быть непродолжительными или не возникать вовсе, вследствие чего первыми проявлениями токсичности могут служить спутанность сознания и сонливость, сменяющиеся комой и дыхательной недостаточностью.
К неврологическим осложнениям спинальной анестезии относятся преходящие неврологические симптомы, такие как боль в пояснице, ягодицах и ногах. Эти симптомы развиваются, как правило, в течение 24 ч после анестезии и разрешаются в течение нескольких дней.
После спинальной анестезии лидокаином и сходными средствами описаны отдельные случаи арахноидита и синдрома конского хвоста со стойкой парестезией, дисфункцией кишечника и мочевыводящих путей или параличом нижних конечностей. Большинство случаев обусловлено гипербарической концентрацией лидокаина или длительной спинальной инфузией.
Признаками токсичности лидокаина могут быть затуманенное зрение, диплопия и преходящий амавроз. Двусторонний амавроз также может быть следствием случайного введения лидокаина в ложе зрительного нерва в ходе офтальмологических процедур. После ретро- или перибульбарной анестезии сообщалось о воспаление глаза и диплопии.
Со стороны органа слуха и лабиринта: звон в ушах, гиперакузия.
Со стороны сердечно-сосудистой системы
Сердечно-сосудистые реакции проявляются артериальной гипотензией, брадикардией, угнетением миокарда (отрицательный инотропный эффект), аритмиями, возможны остановка сердца или недостаточность кровообращения.
Со стороны дыхательной системы: одышка, бронхоспазм, угнетение дыхания, остановка дыхания.
Со стороны пищеварительной системы: тошнота, рвота.
Со стороны кожи и подкожных тканей: сыпь, крапивница, ангионевротический отек, отек лица.
Сообщение о нежелательных реакциях, подозреваемых в связи с лечением
Сообщение о подозреваемых в связи с лечением нежелательных реакциях, возникших после регистрации лекарственного препарата, очень важны. Эти меры позволяют осуществлять мониторинг соотношения пользы и рисков лекарственного препарата. Медицинские работники должны сообщать обо всех подозреваемых в связи с лечением нежелательных реакциях через систему фармаконадзора.
Передозировка
Токсичность со стороны ЦНС проявляется симптомами, нарастающими по тяжести. Сначала может развиться парестезия вокруг рта, онемение языка, головокружение, гиперакузия и шум в ушах. Нарушение зрения и мышечный тремор или мышечные подергивания свидетельствуют о более серьезной токсичности и предшествуют генерализованным судорогам. Эти признаки не следует путать с невротическим поведением. Затем могут наступить потеря сознания и большие судорожные припадки продолжительностью от нескольких секунд до нескольких минут. Судороги приводят к быстрому нарастанию гипоксии и гиперкапнии, обусловленных повышенной мышечной активностью и нарушением дыхания. В тяжелых случаях может развиться апноэ. Ацидоз усиливает токсические эффекты местных анестетиков. В тяжелых случаях возникают нарушения со стороны сердечно-сосудистой системы. При высокой системной концентрации могут развиться артериальная гипотензия, брадикардия, аритмия и остановка сердца, которые могут оказаться летальными.
Разрешение передозировки происходит вследствие перераспределения местного анестетика из ЦНС и его метаболизма, оно может протекать достаточно быстро (если не была введена очень большая доза препарата).
При возникновении признаков передозировки введение анестетика следует немедленно прекратить.
Судороги, угнетение ЦНС и кардиотоксичность требуют медицинского вмешательства. Главные цели терапии заключаются в поддержании оксигенации, прекращении судорог, поддержании кровообращения и купировании ацидоза (в случае его развития). В соответствующих случаях необходимо обеспечить проходимость дыхательных путей и назначить кислород, а также наладить вспомогательную вентиляцию легких (масочную или с помощью мешка Амбу). Поддержание кровообращения осуществляется посредством вливания плазмы или инфузионных растворов. При необходимости длительного поддержания кровообращения, следует рассмотреть возможность введения вазопрессоров, однако они повышают риск возбуждения ЦНС. Контроль судорог можно достичь посредством в/в введения диазепама (0.1 мг/кг) или тиопентала натрия (1-3 мг/кг), при этом следует учитывать, что противосудорожные средства могут также угнетать дыхание и кровообращение. Продолжительные судороги могут препятствовать вентиляции легких и оксигенации пациента, в связи с чем, следует рассмотреть возможность ранней эндотрахеальной интубации. При остановке сердца приступают к стандартной сердечно-легочной реанимации. Эффективность диализа при лечении острой передозировки лидокаина очень низкая.
Лекарственное взаимодействие
Токсичность лидокаина увеличивается при его одновременном применении с циметидином и пропранололом вследствие повышения концентрации лидокаина, это требует снижения дозы лидокаина. Оба препарата снижают печеночный кровоток. Кроме того, циметидин ингибирует микросомальную активность. Ранитидин незначительно снижает клиренс лидокаина, что приводит к повышению его концентрации.
Повышение сывороточной концентрации лидокаина также могут вызывать антиретровирусные средства (например, ампренавир, атазанавир, дарунавир, лопинавир).
Гипокалиемия, вызываемая диуретиками, может снижать действие лидокаина при их одновременном применении.
Лидокаин следует с осторожностью применять у пациентов, получающих другие местные анестетики или средства, структурно сходные с местными анестетиками амидного типа (например, антиаритмическими средствами, такими как мексилетин, токаинид), поскольку системные токсические эффекты носят аддитивный характер.
Отдельные исследования лекарственного взаимодействия между лидокаином и антиаритмическими препаратами III класса (например, амиодароном) не проводились, однако рекомендуется соблюдать осторожность.
У пациентов, одновременно получающих антипсихотические средства, удлиняющие или способные удлинять интервал QT (например, пимозид, сертиндол, оланзапин, кветиапин, зотепин), прениламин, эпинефрин (при случайном в/в введении) или антагонисты серотониновых 5НТ 3 -рецепторов (например, трописетрон, доласетрон), может повышаться риск желудочковых аритмий.
Одновременное применение хинупристина/далфопристина может увеличивать концентрацию лидокаина и повышать, таким образом, риск желудочковых аритмий; одновременного применения следует избегать.
У пациентов, одновременно получающих миорелаксанты (например, суксаметоний), может повышаться риск усиленной и пролонгированной нервно-мышечной блокады.
После применения бупивакаина у пациентов, получавших верапамил и тимолол, сообщалось о развитии сердечно-сосудистой недостаточности; лидокаин близок по структуре к бупивакаину.
Допамин и 5-гидрокситриптамин снижают порог судорожной готовности для лидокаина.
Опиоиды, вероятно, обладают просудорожным действием, что подтверждается данными о том, что лидокаин снижает судорожный порог для фентанила у человека.
Комбинация опиоидов и противорвотных средств, иногда применяемая в целях получения седативного эффекта у детей, может снизить судорожный порог и повысить угнетающее действие лидокаина на ЦНС.
Применение эпинефрина вместе с лидокаином может снизить системную абсорбцию, но при случайном в/в введении резко возрастает риск желудочковой тахикардии и фибрилляции желудочков.
Одновременное применение прочих антиаритмических средств, бета-адреноблокаторов и блокаторов медленных кальциевых каналов может дополнительно снижать AV-проведение, внтурижелудочковую проводимость и сократимость.
Одновременное применение сосудосуживающих средств увеличивает длительность действия лидокаина.
Одновременное применение лидокаина и алкалоидов спорыньи (например, эрготамина) может вызвать тяжелую артериальную гипотензию.
Необходимо соблюдать осторожность при применении седативных средств, поскольку они могут повлиять на действие местных анестетиков на ЦНС.
Следует соблюдать осторожность при длительном применении противоэпилептических средств (фенитоин), барбитуратов и других ингибиторов микросомальных ферментов печени, поскольку это может привести к снижению эффективности и, как следствие, повышенной потребности в лидокаине. С другой стороны, в/в введение фенитоина может усилить угнетающее действие лидокаина на сердце.
Анальгезирующий эффект местных анестетиков может усиливаться опиоидами и клонидином.
Этанол, особенно при длительном злоупотреблении, может снижать действие местных анестетиков.
Лидокаин не совместим с амфотерицином В, метогекситоном и нитроглицерином.
Смешивать лидокаин с другими лекарственными препаратами не рекомендуется.
Особые указания
Введение лидокаина должны осуществлять специалисты, обладающие опытом проведения и оборудованием для реанимации. При введении местных анестетиков необходимо располагать оборудованием для проведения реанимации.
Лидокаин следует с осторожностью применять у пациентов с миастенией gravis, эпилепсией, хронической сердечной недостаточностью, брадикардией и угнетением дыхания, а также в комбинации с препаратами, взаимодействующими с лидокаином и приводящими к повышению его биодоступности, потенцированию эффектов (например, фенитоином) или удлинению выведения (например, при печеночной или терминальной почечной недостаточности, при которой могут кумулировать метаболиты лидокаина).
За пациентами, получающими антиаритмические препараты III класса (например, амиодарон), необходимо установить тщательное наблюдение и ЭКГ-мониторинг, поскольку влияние на сердце может потенцироваться.
В пострегистрационном периоде поступали сообщения о хондролизе у пациентов, которым проводили длительную внутрисуставную инфузию местных анестетиков после операции. В большинстве случаев хондролиз отмечался в плечевом суставе. Вследствие множества вносящих вклад факторов и противоречивости научной литературы относительно механизма реализации эффекта, причинно-следственная связь не выявлена. Длительная внутрисуставная инфузия не является разрешенным показанием к применению лидокаина.
В/м введение лидокаина может повышать активность креатинфосфокиназы, что может затруднить диагностику острого инфаркта миокарда.
Показано, что лидокаин может вызывать порфирию у животных; применение препарата у пациентов с порфирией следует избегать.
При введении в воспаленные или инфицированные ткани эффект лидокаина может снижаться. Перед началом в/в введения лидокаина необходимо устранить гипокалиемию, гипоксию и нарушение кислотно-основного состояния.
Некоторые процедуры местной анестезии могут приводить к серьезным нежелательным реакциям, независимо от применяемого местного анестетика.
Проводниковая анестезия спинномозговых нервов может приводить к угнетению сердечно-сосудистой системы, особенно на фоне гиповолемии, поэтому при проведении эпидуральной анестезии пациентам с сердечно-сосудистыми нарушениями следует соблюдать осторожность.
Эпидуральная анестезия может приводить к артериальной гипотензии и брадикардии. Риск можно снизить предварительным введением кристаллоидных или коллоидных растворов. Необходимо немедленно купировать артериальную гипотензию.
В некоторых случаях парацервикальная блокада при беременности может приводить к брадикардии или тахикардии у плода, в связи с чем, требуется тщательный мониторинг ЧСС у плода.
Введение в область головы и шеи может привести к непреднамеренному попаданию в артерию с развитием церебральной симптоматики (даже в низких дозах).
Ретробульбарное введение в редких случаях может приводить к попаданию в субарахноидальное пространство черепа, приводя к серьезным/тяжелым реакциям, включая сердечно-сосудистую недостаточность, апноэ, судороги и временную слепоту.
Ретро- и перибульбарное введение местных анестетиков несет низкий риск стойкой глазодвигательной дисфункции. К основным причинам относят травму и (или) местное токсическое действие на мышцы и (или) нервы.
Тяжесть подобных реакций зависит от степени травмы, концентрации местного анестетика и продолжительности его экспозиции в тканях. В связи с этим любой местный анестетик необходимо применять в наименьшей эффективной концентрации и дозе.
Лидокаин, раствор для инъекций, не рекомендуется применять у новорожденных. Оптимальная сывороточная концентрация лидокаина, позволяющая избежать такой токсичности, как судороги и аритмии, у новорожденных не установлена.
Следует избегать внутрисосудистого введения, если таковое напрямую не показано.
Препарат следует применять с осторожностью:
- у пациентов с коагулопатией. Терапия антикоагулянтами (например, гепарином), НПВП или плазмозаменителями повышает склонность к кровотечениям. Случайное повреждение сосудов может привести к тяжелым кровотечениям. При необходимости следует проверить время кровотечения, активированное частичное тромбопластиновое время (АЧТВ) и содержание тромбоцитов;
- у пациентов с полной и неполной блокадой внутрисердечной проводимости, поскольку местные анестетики могут угнетать AV-проводимость;
- необходимо тщательно наблюдать за пациентами с судорожными расстройствами на предмет симптоматики со стороны ЦНС. Низкие дозы лидокаина также могут повышать судорожную готовность. У пациентов с синдромом Мелькерссона-Розенталя аллергические и токсические реакции со стороны нервной системы в ответ на введение местных анестетиков могут развиваться чаще;
- в III триместре беременности.
Лидокаин, раствор для инъекций 10 мг/мл и 20 мг/мл, не разрешен для интратекального введения (субарахноидальной анестезии).
Влияние на способность к управлению транспортными средствами и механизмами
После введения местных анестетиков может развиться временная сенсорная и/или моторная блокада. До исчезновения этих эффектов пациентам не следует управлять автотранспортом и работать с механизмами.
Беременность и лактация
Лидокаин разрешается применять при беременности и в период грудного вскармливания. Необходимо строго придерживаться назначенного режима дозирования. При осложнениях или кровотечении в анамнезе проведение эпидуральной анестезии лидокаином в акушерстве противопоказано.
Лидокаин применяли у большого числа беременных женщин и женщин детородного возраста. Какие-либо репродуктивные нарушения не зарегистрированы, т.е. повышения частоты пороков развития не отмечалось.
Вследствие потенциального достижения высокой концентрации местных анестетиков у плода после парацервикальной блокады у него могут развиться нежелательные реакции, такие как фетальная брадикардия. В связи с этим лидокаин в концентрации, превышающей 1%, в акушерстве не применяют.
В исследованиях на животных вредное воздействие на плод не обнаружено.
Лидокаин в небольшом количестве проникает в грудное молоко, биодоступность очень низкая, таким образом, ожидаемое количество, поступающее с грудным молоком, очень небольшое, следовательно, потенциальный вред для ребенка очень низкий. Решение о возможности применения лидокаина в период грудного вскармливания принимает врач.
Данные о влиянии лидокаина на фертильность у человека отсутствуют.
Применение в детском возрасте
При нарушениях функции почек
Лидокаин следует с осторожностью применять при терминальной почечной недостаточности, т.к. могут кумулировать метаболиты лидокаина.
При нарушениях функции печени
Лидокаин следует с осторожностью применять при печеночной недостаточности.
Применение в пожилом возрасте
Пациентам пожилого возраста препарат вводят в меньших дозах, соответствующих их возрасту и физическому состоянию.
Условия отпуска из аптек
Условия и сроки хранения
Препарат следует хранить в недоступном для детей месте при температуре от 15° до 25°С. Срок годности — 5 лет.
Источник статьи: http://health.mail.ru/drug/lidokain/
Лечение нарушений ритма и проводимости на догоспитальном этапе
Острые аритмии и блокады, которые могут осложнить течение заболеваний сердечно-сосудистой системы — ИБС (включая инфаркт миокарда, постинфарктный кардиосклероз), ревматических пороков сердца, первичных и вторичных кардиомиопатий, иногда развиваются вслед
Острые аритмии и блокады, которые могут осложнить течение заболеваний сердечно-сосудистой системы — ИБС (включая инфаркт миокарда, постинфарктный кардиосклероз), ревматических пороков сердца, первичных и вторичных кардиомиопатий, иногда развиваются вследствие врожденных аномалий проводящей системы (синдромы Вольфа-Паркинсона-Уайта — WPW, Лауна-Генонга-Левайна — LGL). Аритмии нередко возникают на фоне артериальной гипертензии, застойной сердечной недостаточности, электролитных расстройств (например, гипокалиемии, гипомагниемии). Их появление могут спровоцировать прием лекарственных средств (сердечных гликозидов, теофиллина; препаратов, удлиняющих интервал QT, — терфенадина, цизаприда), алкоголя, а также избыточное употребление кофеинсодержащих напитков.
На догоспитальном этапе целесообразно выделить те нарушения ритма, при которых показана неотложная терапия (см. табл.).
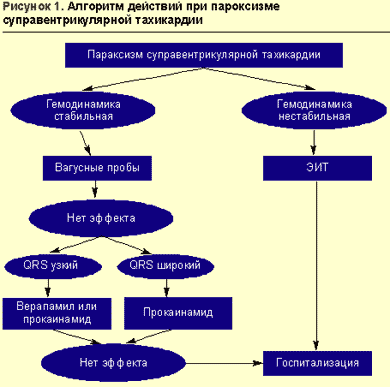
Пароксизмальная суправентрикулярная тахикардия
Врачебная тактика при пароксизме суправентрикулярной тахикардии (ПСВТ) определяется стабильностью гемодинамики пациента. Падение артериального давления (АД) с развитием синкопального состояния, приступ сердечной астмы, отек легких, развитие тяжелого ангинозного приступа на фоне тахикардии являются показаниями для немедленной электроимпульсной терапии.
При относительно стабильной гемодинамике выбор лекарственного препарата зависит от электрокардиографической картины (рис. 1).
Тахикардия с «узкими» комплексами QRS (QRS неизмененной формы не более 0,1 с) купируется введением антагониста кальция верапамила (изоптина), удлиняющего рефрактерный период в атриовентрикулярном узле. Препарат вводится в/в болюсно в дозе 2,5-5 мг за 2-4 мин (во избежание развития коллапса или выраженной брадикардии) с возможным повторным введением 5-10 мг через 15-30 мин при сохранении тахикардии и отсутствии гипотензии.
К побочным эффектам верапамила относятся: брадикардия (вплоть до асистолии при быстром внутривенном введении за счет подавления автоматизма синусового узла); AV-блокада (вплоть до полной поперечной при быстром внутривенном введении); преходящая желудочковая экстрасистолия (купируется самостоятельно); артериальная гипотензия вследствие периферической вазодилатации и отрицательного инотропного действия (вплоть до коллапса при быстром внутривенном введении); нарастание или появление признаков сердечной недостаточности (за счет отрицательного инотропного действия); отек легких. Со стороны ЦНС отмечаются головокружение, головная боль, нервозность, заторможенность, покраснение лица, периферические отеки, чувство нехватки воздуха, одышка, аллергические реакции.
Верапамил следует применять только при нарушениях ритма с «узким» комплексом QRS. При «широком» комплексе QRS и подозрении на синдром Вольфа-Паркинсона-Уайта (синдром WPW) препарат противопоказан, так как он укорачивает рефрактерный период дополнительных путей проведения и может вызвать увеличение ЧСС и фибрилляцию желудочков. Диагностика синдрома WPW возможна при соответствующих анамнестических указаниях и/или при оценке предыдущих ЭКГ с синусовым ритмом (интервал PQ менее 0,12 с, комплекс QRS расширен, определяется дельта-волна). Другими противопоказаниями к применению верапамила являются:
- абсолютные: выраженная брадикардия, синдром слабости синусового узла, AV-блокада II и III степени, кардиогенный шок, хроническая и острая сердечная недостаточность, повышенная чувствительность к препарату;
- относительные: брадикардия с ЧСС менее 50 в минуту, AV-блокада I степени, желудочковая тахикардия, артериальная гипотензия (САД менее 90 мм рт. ст.).
Кроме того, верапамил противопоказан пациентам, у которых в течение последних двух часов применялся какой-либо бета-адреноблокатор.
Альтернативой верапамилу может служить прокаинамид (новокаинамид); его можно также использовать в случае неэффективности верапамила, но не ранее чем через 15 мин после введения последнего и при условии сохранения стабильной гемодинамики. Прокаинамид эффективен при реципрокных тахикардиях у пациентов с синдромом WPW (в тех случаях, когда верапамил противопоказан). Прокаинамид вводится в/в медленно в дозе 1000 мг в течение 8-10 мин (10 мл 10%-ного раствора, доведенные до 20 мл изотоническим раствором хлорида натрия) с постоянным контролем АД, ЧСС и ЭКГ (в случае резкого расширения комплеков QRS введение должно быть остановлено). В момент восстановления синусового ритма введение препарата прекращается. В связи с возможностью снижения АД при введении прокаинамида больной должен находиться в горизонтальном положении, необходимо также заготовить шприц с 0,1 мг фенилэфрина (мезатона).
К побочным эффектам прокаинамида относятся аритмогенное действие, желудочковые нарушения ритма вследствие удлинения интервала QT, замедление атривентрикулярной и внутрижелудочковой проводимости, артериальная гипотензия, головокружение, слабость, нарушения сознания, депрессия, бред, галлюцинации, аллергические реакции.
Противопоказания к применению прокаинамида — артериальная гипотензия, кардиогенный шок, хроническая сердечная недостаточность, синоатриальная и AV-блокады II и III степени, внутрижелудочковые нарушения проводимости, удлинение интервала QТ и указания на эпизоды «пируэтной» тахикардии в анамнезе, выраженная почечная недостаточность, системная красная волчанка, повышенная чувствительность к препарату. Токсический эффект новокаинамида устраняется в/в струйным введением 100 мл 5%-ного раствора натрия гидрокарбоната.
Возможно также использование бета-адреноблокаторов (пропранолола) и сердечных гликозидов (дигоксина), но их эффективность при пароксизмальной суправентрикулярной тахикардии составляет только 40-55%. Если больному уже введен верапамил, то пропранолол (обзидан, анаприлин) можно использовать не ранее чем через 30 мин сублингвально в дозе 10-20 мг. Препарат противопоказан при артериальной гипотензии и синдроме бронхиальной обструкции. В/в введение пропранолола в дозе до 0,15 мг/кг со скоростью не более 1 мг/мин желательно осуществлять под контролем ЭКГ-монитора в условиях кардиоблока. Пропранолол высокоэффективен при пароксизмальной тахикардии, обусловленной кругом «повторного входа» (re-entry) в синусовом или атриовентрикулярном узле; при других вариантах тахикардии его применение позволяет снизить ЧСС. Дигоксин в начальной дозе 0,25-0,5 мг эффективен при узловой реципрокной тахикардии, в остальных случаях он только уменьшает ЧСС. Дигоксин не показан при синдроме WPW по тем же причинам, что и верапамил.
Терапию пароксизмальной суправентрикулярной тахикардии в условиях специализированного кардиореанимобиля и в стационаре возможно проводить путем в/в введения АТФ (или аденозина), прерывающей круг «повторного входа»: 10 мг (1 мл 1%-ного раствора) АТФ вводят в/в в течение 5-10 с, при отсутствии эффекта через 2-3 мин повторно вводят еще 20 мг (2 мл 1%-ного раствора). При использовании аденозина (аденокора) начальная доза составляет 3 мг (1 мл). Эффективность препарата при этом виде нарушений ритма составляет 90-100%. Как правило, удается купировать пароксизмальную суправентрикулярную тахикардию в течение 20-40 с после введения АТФ.
Введение аденозина в/в позволяет также дифференцировать трепетание предсердий с проведением 1:1 и суправентрикулярную тахикардию; угнетение AV-проведения позволяет выявить характерные волны трепетания, однако ритм при этом не восстанавливается.
Противопоказаниями к применению препарата являются AV-блокада II и III степени, синдром слабости синусового узла (при отсутствии искусственного водителя ритма), повышенная чувствительность к аденозину. Также следует учитывать, что введение АТФ или аденозина может спровоцировать приступ у больных бронхиальной астмой.
Необходимо принимать во внимание, что внутривенное введение болюса аденозина (АТФ) при суправентрикулярных пароксизмах примерно в 50% случаев приводит к 5-15-секундной асистолии, а в 0,2-3% случаев асистолия может затягиваться более чем на 15 с, что может потребовать нанесения прекордиального удара и даже проведения непрямого массажа сердца (требуется всего несколько массажных движений). Из-за риска развития подобных осложнений применение аденозина (АТФ) допустимо только в условиях специализированного реанимобиля или в стационаре.
Фибрилляция и трепетание предсердий
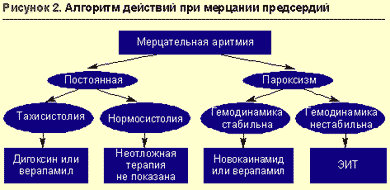
При лечении пациентов с мерцанием и трепетанием предсердий на догоспитальном этапе должна быть оценена целесообразность восстановления синусового ритма.
Абсолютным показанием к восстановлению синусового ритма при развитии пароксизма мерцательной аритмии является развитие отека легких или аритмогенного шока; в этом случае на догоспитальном этапе должна быть проведена экстренная кардиоверсия.
Противопоказаниями к восстановлению синусового ритма на догоспитальном этапе можно считать длительность пароксизма мерцания предсердий более двух дней, доказанную дилатацию левого предсердия (передне-задний размер 4,5 см, по данным ЭхоКГ), наличие тромбов в предсердиях или тромбоэмболические осложнения в анамнезе, развитие пароксизма на фоне острого коронарного синдрома (при наличии стабильной гемодинамики), развитие пароксизма на фоне выраженных электролитных нарушений, декомпенсацию тиреотоксикоза. При отказе от восстановления синусового ритма необходимо установить контроль над частотой сердечных сокращений в целях поддержания ее в пределах 60-90 ударов в минуту.
Средством выбора для контроля частоты сердечного ритма являются сердечные гликозиды: 0,25 мг дигоксина (1 мл 0,025%-ного раствора) в 20 мл изотонического раствора хлорида натрия вводятся в/в, медленно болюсно. Дальнейшая тактика определяется в стационаре. Постоянная нормосистолическая форма мерцательной аритмии без признаков сердечной недостаточности вообще не нуждается в антиаритмической терапии (рис. 2). Побочные эффекты дигоксина (проявления дигиталисной интоксикации) — брадикардия, AV-блокада, предсердная тахикардия, желудочковая экстрасистолия, анорексия, тошнота, рвота, диарея, головная боль, головокружение, нарушение зрения, синкопальное состояние, возбуждение, эйфория, сонливость, депрессия, нарушения сна, спутанность сознания.
Противопоказания к применению дигоксина:
- абсолютные: гликозидная интоксикация, повышенная чувствительность к препарату;
- относительные: выраженная брадикардия (отрицательное хронотропное действие); AV-блокада II и III степени (отрицательное дромотропное действие); изолированный митральный стеноз и нормо- или брадикардия (опасность дилатации левого предсердия с усугублением левожелудочковой недостаточности вследствие повышения давления в его полости; опасность развития отека легких вследствие увеличения сократительной активности правого желудочка и нарастания легочной гипертензии); идиопатический гипертрофический субаортальный стеноз (возможность увеличения обструкции выхода из левого желудочка вследствие сокращения гипертрофированной межжелудочковой перегородки); нестабильная стенокардия и острый инфаркт миокарда (опасность увеличения потребности миокарда в кислороде, а также возможность разрыва миокарда при трансмуральном инфаркте миокарда вследствие повышения давления в полости левого желудочка); синдром WPW (улучшает проведение по дополнительным путям), частая или политопная желудочковая экстрасистолия, пробежки желудочковой тахикардии.
Препаратом выбора для восстановления синусового ритма при стабильной гемодинамике является прокаинамид.
В ряде случаев альтернативой прокаинамиду может служить верапамил. Он не всегда восстанавливает синусовый ритм, но эффективно снижает ЧСС путем блокирующего влияния на атриовентрикулярный узел. Нельзя, однако, забывать о том, что при мерцательной аритмии у пациентов с синдромом WPW не показано использование верапамила (препарат улучшает проведение по дополнительным путям).
При магнийзависимом мерцании предсердий (доказанная гипомагниемия или наличие удлиненного интервала QT) препаратом выбора служит сульфат магния (кормагнезин), являющийся в остальных случаях дополнительным средством для замедления (снижения частоты сокращений) ритма.
При неэффективности одного антиаритмического препарата медикаментозная терапия на догоспитальном этапе прекращается, в случае появления осложнений (см. выше) проводится электроимпульсная терапия.
Трепетание предсердий с низким атриовентрикулярным проведением, приводящим к невыраженной тахикардии, и при отсутствии осложнений не требует экстренной терапии.
При нестабильной гемодинамике, развитии осложнений на фоне трепетания предсердий с высокой частотой сердечных сокращений (AV-проведение 1:1) показана экстренная электроимпульсная терапия.
Неосложненное трепетание предсердий с высокой частотой сокращений желудочков на догоспитальном этапе требует только замедления сердечного ритма, для чего используются дигоксин или верапамил. Применение в этом случае бета-адреноблокаторов наименее целесообразно, хотя и возможно.
Желудочковые нарушения ритма
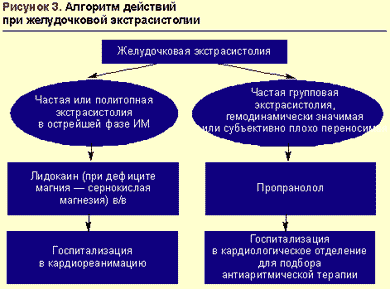
В большинстве случаев как желудочковая, так и наджелудочковая экстрасистолия не является «злокачественным» нарушением ритма и не требует немедленного терапевтического вмешательства (исключение — частая и/или политопная желудочковая экстрасистолия при инфаркте миокарда). В этом случае вариантом выбора могут быть бета-адреноблокаторы для перорального приема. С позиций сегодняшнего дня оптимально назначение селективных препаратов с липофильными свойствами. Наиболее изученный препарат этой группы — метопролол, применение которого в суточной дозе 50–200 мг (в два приема) рекомендуется в первую очередь пациентам, у которых экстрасистолия является проявлением ИБС и/или сопровождает артериальную гипертензию.
При остром инфаркте миокарда препаратом выбора для купирования желудочковых нарушений ритма является лидокаин (рис. 3).
В условиях стабильной гемодинамики средством выбора для купирования желудочковой тахикардии (ЖТ) является лидокаин, вводимый в/в болюсно в дозе 1-2 мг/кг (80-100 мг) в течение 3-5 мин с последующей поддерживающей капельной инфузией длительностью до 24-36 ч со скоростью 20-55 мкг/кг/мин (максимально 4 мг/мин). При необходимости на фоне инфузии допустимо дополнительное струйное введение лидокаина в дозе 40 мг через 10-30 мин после первого болюса. Удлинение интервала QT и увеличение его дисперсии — показания к усилению поддерживающей терапии путем капельного введения кормагнезина (магния сульфата) со скоростью 3-20 мг/мин. В дальнейшем возможен переход на профилактическое в/м введение лидокаина в дозе 2-4 мг/кг (160-200 мг, максимально 600 мг, а при инфаркте миокарда не более 300 мг) каждые 4-6 часов.
В случае неэффективности лидокаина применение других антиаритмиков для купирования ЖТ показано при сохранении стабильной гемодинамики и отсутствии нежелательных реакций (опасность коллапса и потенцирования аритмогенного действия антиаритмических препаратов) либо когда невозможно проведение электроимпульсной терапии. В этих случаях вторым по значимости препаратом является прокаинамид (новокаинамид), вводимый с соответствующими предосторожностями в/в дробными дозами по 100 мг/5 мин до восстановления синусового ритма или достижения насыщающей дозы (500-1000 мг).
Эффективность прокаинамида при всех пароксизмальных тахикардиях делает его препаратом выбора для лечения тахикардии неустановленной природы с широким комплексом QRS (желудочковой или суправентрикулярной с аберрацией проведения).
Препаратом выбора при желудочковой тахикардии типа «пируэт» и дополнительным средством при других видах желудочковой тахикардии (в том числе рефрактерных к терапии лидокаином и новокаинамидом) является сульфат магния (кормагнезин), вводимый в/в в течение 10-15 мин в дозе 400-800 мг магния (20-40 мл 10%-ного или 10-20 мл 20%-ного раствора). При отсутствии эффекта препарат вводится повторно через 30 мин. По достижении эффекта поддерживающая терапия заключается в капельном введении кормагнезина (магния сульфата) со скоростью 3-20 мг/мин в течение 2-5 ч.
Желудочковая тахикардия при нестабильной гемодинамике требует немедленной электроимпульсной терапии (рис. 4).
Брадиаритмии
Брадиаритмии (синусовая брадикардия, синоаурикулярная блокада, медленный замещающий атриовентрикулярный ритм, нарушения атриовентрикулярной проводимости II и III степени) требуют терапии в тех случаях, когда эти состояния сопровождаются нестабильной гемодинамикой и возникают как осложнение органического поражения сердца или развиваются при проведении реанимационных мероприятий, а также при появлении частых приступов Морганьи-Эдемса-Стокса. Для восстановления гемодинамики бывает достаточно увеличить ЧСС в/в введением 0,1%-ного раствора атропина сульфата в дозе 0,3-1,0 мл с повторением начальной дозы (при ее эффективности) через 4-5 ч.
К побочным эффектам атропина относятся сухость во рту, жажда, тошнота, рвота, атония кишечника и запоры, усиление кашля у больных бронхиальной астмой, нарушения мочеотделения, мидриаз, фотофобия, паралич аккомодации, тахикардия, беспокойство, тремор, головная боль, психомоторное возбуждение.
Противопоказаниями к применению атропина являются глаукома, хроническая задержка мочи, атония кишечника, тахикардия, тяжелая сердечная недостаточность, выраженный атеросклероз, повышенная чувствительность к препарату. При брадиаритмиях и AV-блокадах допустимо использование атропина по витальным показаниям даже при ишемии миокарда, кишечной непроходимости, атонии кишечника, болезнях печени и почек, закрытоугольной форме глаукомы.
Неэффективность терапии атропином служит показанием к временной электрокардиостимуляции, а при невозможности ее проведения по жизненным показаниям используется орципреналин (в дозе 10-30 мкг/мин под контролем ЧСС в/в капельно до появления терапевтического эффекта).
О. Б. Талибов, кандидат медицинских наук
А. В. Тополянский, кандидат медицинских наук
Источник статьи: http://www.lvrach.ru/2002/03/4529295