Управление работоспособностью яичников и репродуктивной функцией происходит через объединение таких структур, как гипоталамус и гипофиз. Клетки нейроны, располагающиеся в особенной области головного мозга, отвечают за производимость гормонов, стимулирующих или, наоборот, угнетающих работоспособность внутренних органов и систем. Данный гормон имеет название – гонадропин – релизинг гормон, который вырабатывается непосредственно в гипоталамусе и представляет собой очень массивное сведение белков, отвечающее за стимуляцию производимости лютеинизирующего и фолликулостимулирующего гормона. В состав группы рилизинг – факторов входят следующие биологические компоненты, такие как:
- Кортикотропин – риллизинг гормон;
- Соматолиберин;
- Тиреолиберин.
Все вышеописанные вещества оказывают воздействие на клетки, которые располагаются в передней доли гипофиза, где непосредственно и происходит синтез одноимённый тропных гормонов.
Выброс гормона ГнРГ в кровоток происходит один раз в течении 60 минут. Данное явление обеспечивает чувствительность к влиянию рецепторов гипофиза и способствует благоприятному функционированию органов репродуктивной системы. Когда происходит какой-либо сбой и начинается увеличение количества и частоты поступления гонадорелина в кровь происходит утрата чувствительности к воздействию рецепторов и как результат этого явления нарушается месячный цикл. В случае очень редкого поступления ГнРГ в кровоток в организме женщины не происходит овуляторный процесс, а также не наступают менструации в течении длительного временного периода.
Выделение гонадотропин-рилизинг гормона зависит от влияния таких биологически активных веществ, как:
- Норадреналин;
- Серотонин;
- Ацетилхолин;
- Гамма-аминомасляная кислота;
- Дофамин.
Частые стрессы, эмоциональные угнетения, плохой сон оказывают негативное влияние на функционирование репродуктивной системы, но помимо отрицательных факторов есть и положительные, которые воздействуют благоприятно на работоспособность половых органов. Основными из них являются:
- здоровый образ жизни;
- сбалансированное питание;
- положительные эмоции;
- отсутствие стрессовых ситуаций.
Антагонистами гонадотропин – рилизинг гормона являются следующие медикаментозные средств, такие как:
Вышеописанные препараты оказывают воздействие на организм человека, угнетая при этом производимость лютеотропина и фолликулостимулирующего гормонов. Наиболее часто данные лекарственные препараты применяют в период подготовки к экстракорпоральному оплодотворению. На сегодняшний день использование медикаментов дает возможность стимулировать овуляцию, в период которой происходит созревание не одной яйцеклетки готовой к оплодотворению, а одновременно нескольких. Данное явление в медицинской практике имеет название суперовуляция.
Для достижения этого состояния применяют агонисты гонадотропин – рилизинг гормона, которые обязательно нужно вводить по специально разработанной схеме. В результате введения таких лекарств происходит увеличение концентрации эстрадиола и может произойти ранний выброс пикового количества ЛГ. В результате этого процесс овуляции начинается раньше времени, яйцеклетки начинают теряться и их нельзя использовать для дальнейшего искусственного оплодотворения.
В свою же очередь, антагонисты при попадании в организм человека начинают активно связываться с рецепторами ГнРГ и их воздействие начинается через пару часов после непосредственного введения. Длительность данных медикаментов должна быть такой, чтобы произошел полноценный рост и развитие фолликулов, и не наступила преждевременная овуляция. Спустя 12 часов после введения антагонистов гипофиз опять готов к применению данного лекарственного средства, которое позволит наступлению состояния суперовуляции и созреванию нескольких женских половых клеток. При использовании такой схемы уменьшается опасность возникновения гиперстимуляции яичников, которая может развиться в случае очень продолжительного применения агонистов гонадолиберина.
Данное состояние сопровождается значительным увеличением яичников в объёме, а также появлением брюшной водянки, патологического накопления жидкости в плевральной полости, а также сгущению крови и образованием тромбов. Прием антагонистов гонадотропин – рилизинг гормона начинают с 5 либо 6 дня после начала использования фолликулостимулирующих гормонов. Когда происходит увеличение фолликулов до размеров 17 – 19 мм прекращают использование антагонистов.
Препараты, которые являются антагонистами гонадорелина, прошли огромное количество исследований и являются безопасными лекарственными средствами, которые используются для терапии бесплодия.
Широко известными и наиболее часто применяемыми препаратами антагонистами гонадотропин – рилизинг гормона являются Цетротид и Оргалутран. Именно эти два медикамента прошли регистрацию и их можно приобрести в аптеках на территории Российской Федерации.
Лекарство Цетроцид производится в виде порошка, предназначенного для приготовления раствора для инъекций, который имеет дозировку 0,25 мг или 3 мг. Оргалутран также выпускается в виде раствора для подкожного введения дозировка которого составляет 0, 25 мг.
В связи с тем, что препарат Цетротид имеет две разные дозировки его можно вводить двумя разными способами. Первым является однократное введение медикамента в количестве 3 мг. Терапевтическая эффективность данного лекарства после введения длится на протяжении 96 часов. По окончанию этого ременного периода можно ввести поддерживающую дозу в количестве 0,25 мг. Вторим способом применения Цетротида является ежедневное введение минимального количества в размере 0, 25 мг. Препарат Оргалутран также вводят каждый день используя при этом дозировку 0,25 мг.
Огромным преимуществом при однократном введении большого количества лекарственного средства Цетротид является уменьшение количества инъекций, а введение дополнительной дозировки 0,25 мг происходит один раз в каждом 10 цикле индукции. Недостатком использования такого количества является увеличение риска развития отрицательного эффекта на фолликулах, которые активно растут и развиваются. Это вызвано тем, что происходит сильное снижение производимости лютеинизирующего гормона.
По результатам огромного количества исследований, в которых происходило сравнение двух протоколов, было выявлено, что частота наступления беременности была одинаковой и в первом и во втором случае.
Эффект после использования медикаментозного препарат наступает в максимально краткие сроки. В связи с этим для стимулирования яичников не нужна длительная подготовка. В период подготовки к стимуляции очень важно выбрать подходящую тактику и определить время в период, которого необходимо проводить подавление синтезирования гонадотропинов, с профилактической целью не наступления пика лютеинизирующего гормона.
Существует два метода введения протоколов, в период которых поменяется антагонисты ГнРГ, которые не схожи между собой и являются полной противоположностью друг друга.
Суть данного метода заключается в введении первой инъекции препаратов антагонистов гонадотропин – рилизинг гормона в зависимости от концентрации эстрадиола в крови либо от степени созревания фолликула и его величины.
Первое введение лекарства выполняют в обусловленный день цикла (зачастую этими днями являются шестой или седьмой).
Вышеописанные методы ведения протоколов, в которых применяются препараты антагонисты-гнрг, были протестированы при помощи специально разработанных тестов. По результатам этих исследований было выявлено, что вопреки одинаковому количеству посещений ультразвукового обследования, женщины, которым была применена терапия по первому типу, а, точнее, по гибкому протоколу, понадобилось меньшее количество инъекций и меньшая дозировка медикаментов – антагонистов гонадотропин – рилизинг гормона. Помимо этого, у них также отмечалось большее количество зрелых ооцитов.
Иными словами, адаптирование того или иного протокола под личные особенности ответа фолликулярного аппарата женщины на протяжении всего периода стимулирования созревания более нежели одной яйцеклетки дает возможность не использовать инъекций, которые не являются нужными, а также осуществить оптимизацию реакции яичников на процесс стимуляции. Стимуляция наступления суперовуляции по гибкому графику дает возможность сэкономить использование как минимум одной ампулы антагониста гонадотропин – рилизинг гормона, а также около 100 Ме гонадотропинов. Но при этом было замечено, что в случае введения антагонистов позже, нежели 8 день происходит снижение шанса наступления желаемой беременности.
Антагонисты гонадотропин – рилизинг гормона – это особенные лекарственные соединения, которые являются безопасными для человеческого организма и активно способствуют стимуляции суперовуляции и последующему наступлению беременности. И, невзирая на то, что уже очень длительный период времени этих медикаментов насчитывается только две единицы, они не престают пользоваться огромным спросом. Разработка антагонистов гонадотропин – рилизинг гормона дала возможность совершить небольшой переворот в области репродуктивной медицины. Применение данных лекарственных средств дает возможность индивидуально подобрать терапию лично для каждого пациентка в период подготовки к искусственному оплодотворению. Огромными плюсами использования данных веществ, помимо индивидуально подобранного количества и способа введение, является также альтернативный подход к контролю наступления суперовуляции. В результате этого происходит снижение риска развития повышенного фолликулярного ответа.
Несмотря на это есть и отрицательные стороны, над которыми работают ученые для их устранения. В некоторых случаях использование протоколов совместно с препаратами антагонистами гонадотропин – рилизинг гормона характеризуется незначительным увеличением опасности пропуска наступления преждевременного пика лютеинизирующего гормона. В связи с этим возникает склонность к уменьшению частоты наступления беременности. В этом случае женщину нужно снять с цикла вспомогательных репродуктивных технологий, при этом ввести триггер овуляции, который приводит к снижению численности зрелых ооцитов.
До сегодняшнего дня ещё проводятся исследования для усовершенствования антогонистов гонадотропин – рилизинг гормона с целью достижения максимальных результатов в терапии бесплодия и увеличения шансов наступления беременности.
источник
Антагонисты ГнРГ(гонадотропин-рилизинг гормона): Оргалутран (Ganirelix/Orgalutran); Цетротид (Cetrorelix/Cetrotide)
В это довольно сложно поверить, но возможность стимуляции яичников доступна человеку уже почти век. Долгая история управления функцией яичников начиналась с длительной латентной фазы контролируемой индукции фолликулярного ответа в условиях ановуляторной яичниковой функции. Ворвавшиеся 30 лет назад в практическую медицину технологии экстракорпорального оплодотворения (ЭКО) поставили перед методикой стимуляции яичников вполне конкретную новую задачу индукции мультифолликулярного ответа, названной позднее, как «стимуляция суперовуляции» или «контролируемая овариальная гиперстимуляция», тем самым сформулировав концепцию об увеличении шансов пропорционально количеству доступных ооцитов хорошего качества (Ludwig M и соавт., 2002г). 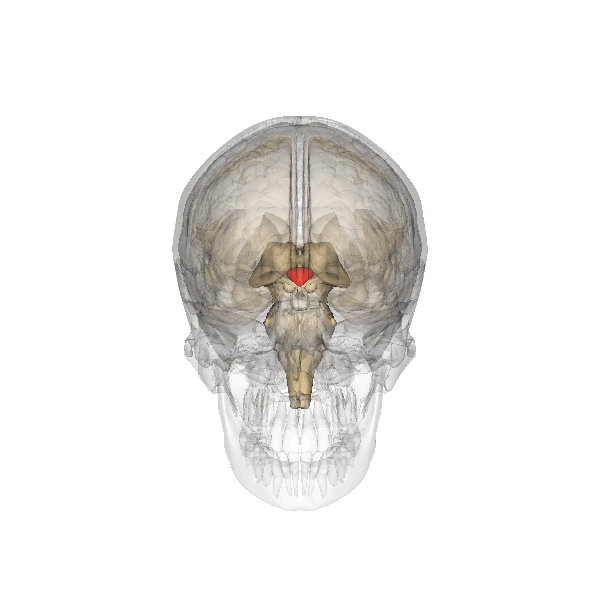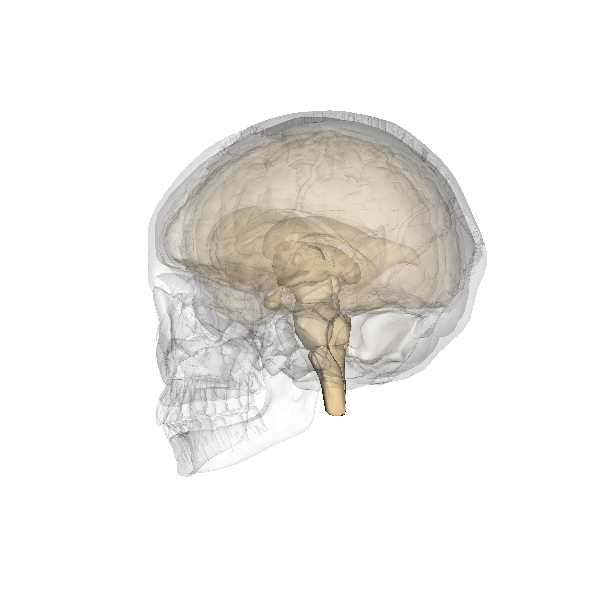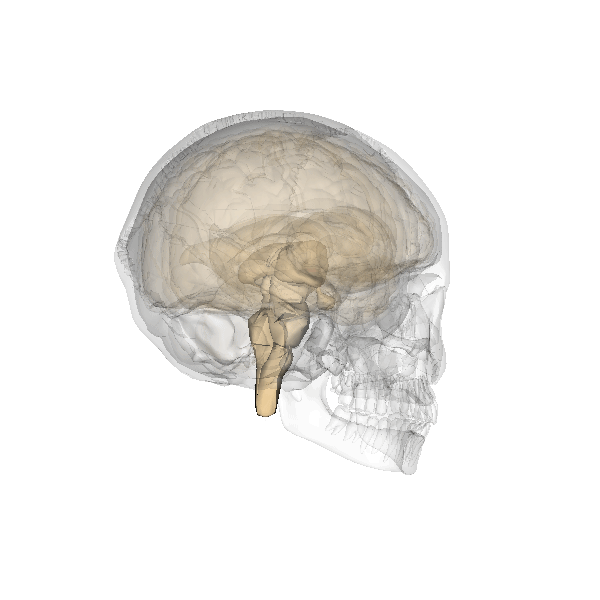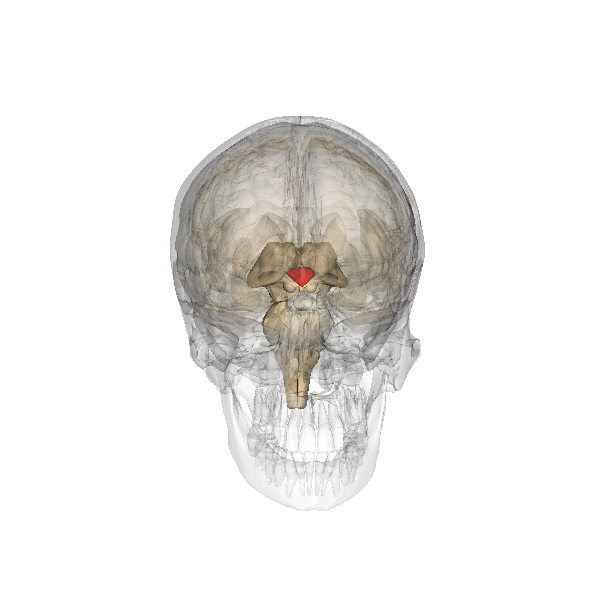
Идея исключения возможности паразитарного пика ЛГ, путем подавления активности гонадотропин-рилизинг гормона (ГнРГ) на уровне его рецепторов в гипофизе появилась давно, но реализовать ее удалось только в 80-ых годах прошлого века. Porter RN и соавт., 1984г, опубликовали первое сообщение об успешном использовании агониста- ГнРГ с целью контроля над когортой развивающихся фолликулов путем подавления эндогенного пика ЛГ до нужного дня лечебного цикла, с последующей заменой триггера на экзогенный ХГЧ. Однако идея была реализована лишь частично. Как оказалось, агонисты- ГнРГ в некоторой мере оправдывают свое название, сопровождаясь периодом активации (flare-up/эффект вспышки) высвобождения ЛГ и ФСГ из гипофиза в первые несколько (как правило, от 7 до 14) дней активности препарата и лишь по истечении этого периода постоянного взаимодействия агониста-ГнРГ и рецептора ГнРГ в гипофизе в тоническим режиме развивается состояние десенситизации к цирхоральным ритмам эндогенного ГнРГ, и как следствие подавление выработки собственных ЛГ и ФСГ. Возникновение эффекта вспышки на старте введения агониста-ГнРГ ограничило возможности использования данных препаратов. Так, со временем появились протоколы контролируемой индукции обходящие активирующий эффект агонистов-ГнРГ (длинный протокол) или пытающиеся его использовать на старте развития когорты фолликулов (короткий и ультракороткие протоколы), последние теоретически приближали индуцированный цикл по философии к естественному, но как показал опыт, такие протоколы оказались заметно менее эффективными в сравнении с длинным протоколом на агонистах-ГнРГ (Daya S., 2000г), что, в частности, на данном этапе развития репродуктивной медицины практически поставило на них крест.
Высказывалась идея, что истинно сблизить концепции лечебного индуцированного цикла и естественного возможно только в протоколах прикрытия выброса паразитарного пика ЛГ антагонистом ГнРГ на рецепторе ГнРГ гипофиза. Логика такого лечебного цикла подразумевает проведение индукции суперовуляции с начала фолликулярной фазы естественного менструального цикла, путем добавления экзогенного ФСГ до введения триггера, с этапом выключения собственной гипофизарной активности только в критический период, когда развивающиеся антральные фолликулы приобретут чувствительность к высоким концентрациям паразитарного ЛГ. Предполагалось, что такой подход наиболее физиологичен и во многом соответствует естественному менструальному циклу, кроме того он наиболее приемлем с позиции дружелюбности к пациентке, так как предполагает сокращение длительности лечения и общего количества инъекций, а отсутствие подавления выработки эндогенных гонадотропинов на старте лечения, должно сочетаться со снижением общей стоимости медикаментозного сопровождения протокола стимуляции.
Разработка же препаратов, имеющих истинно быстрый блокирующий эффект на рецепторы ГнРГ гипофиза затянулось еще на одно десятилетие, что впрочем в масштабах фармакологии не так уж и много. Несмотря на то, что концепт-антагонисты ГнРГ были значительно более сложны и дороги в синтезе, основной проблемой с которой столкнулись разработчики оказалось даже не это, а то, что их прием сопровождался высокой частотой осложнений по типу аллергических реакций, связанной с высвобождением гистамина и плохой физической растворяемостью.
Знакомство с препаратами и протоколами
Наконец, были разработаны четыре лекарственные соединения, обладающие сочетанием адекватного ант-ГнРГ действия и безопасности, прошедшие должные доклинические и клинические испытания в рамках протоколов стимуляции яичников с целью лечения бесплодия:
- Nal-Glu
- Antid
- Cetrorelix («Цетротид/Cetrotide»).
- Ganirelix («Оргалутран/Orgalutran/Antagon»).
В данном обсуждении основное внимание уделяется двум последним лекарственным соединениям (Cetrorelix и Ganirelix), так как только эти препараты зарегистрированы в национальном реестре (Цетротид и Оргалутран, соответственно), являясь коммерчески доступными на территории Российской Федерации.
| Ganirelix (Оргалутран) | Cetrorelix (Цетротид) |
 |
 |
Режим введения антагонистов ГнРГ
Цетротид представлен в двух различных дозах:
- Cetrotide 0,25мг
- Cetrotide 3 мг
Оргалутран имеет только одну дейли-форму
- Orgalutran 0,25мг. Минимальная терапевтическая доза выведена эмпирически из многоцентрового клинического исследования (The Ganirelix Dose-finding Study Group.Adouble-blind, randomized, dose-finding study to assess the efficacy of the gonadotrophin-releasing hormone ntagonist ganirelix (Org 37462) to prevent premature luteinizing hormone surges in women undergoing ovarian stimulation with recombinant follicle stimulating hormone (Puregon). Hum Reprod, 1998г)
Иными словами Цетротид допускает использование в двух принципиально разных протоколах
- Однократного введения большой дозы (3мг), с продолжающимся эффектом действия препарата до 96 часов. При необходимости по истечении 96 часов вводятся поддерживающие дейли дозы 0,25мг. Минимальная терапевтическая доза в 3мг выведена эмпирически из выводов нескольких клинических исследований (Olivennes F и соавт.,1995г, 1998г, 2001г.)
- Ежедневного введения минимальной дозы в 0,25мг, собственно, как и Оргалутран. Минимальная терапевтическая доза выведена также эмпирически из выводов нескольких клинических исследований (Diedrich K и соавт.,1994г.; Felberbaum R и соавт., 1996г.;Albano C и соавт., 1997г.)
Бесспорным преимуществом однократного введения большой дозы Цетротида является сокращение количества инъекций, при этом дополнительные дейли дозы 0,25мг необходимы только в каждом десятом цикле индукции (Olivennes и соавт., 2000г). Однако, значительное увеличение дозы, грозит развитием негативного эффекта на развивающиеся фолликулы, в связи с глубоким угнетением синтеза ЛГ. Здесь стоит сразу отметить, что исследование (Olivennes и соавт., 2003г), призванное сравнить протоколы с многократным и однократным введением Цетротида, не выявило различий в частоте наступления беременности. Так же другое перспективное рандомизированное клиническое исследование не нашло различий по частоте наступления клинической беременности между протоколами с многократным введением ганиреликса и однократным введением цетрореликса (Wilcox и соавт., 2005г.). Но, в попытке оценки влияния высоких доз ганиреликса факт значительного снижение частоты наступления клинической беременности был зафиксирован однозначно, что собственно говоря, и запретило дальнейшие попытки изысканий в вопросе сокращения числа инъекций ганиреликса за счет увеличения вводимой дозы.
Режим введения гонадотропинов
Классический протокол под прикрытием антагониста ГнРГ подразумевает, что введение гонадотропина начинается со 2-3 дня менструального цикла вплоть до дня введения триггера овуляции, с коррекцией ежедневной дозы по требованию. При этом с момента введения антагониста ГнРГ, при хорошей динамике роста фолликулов, увеличение дозы ФСГ не улучшает прогноз лечения (Propst AM, Bates GW и соавт., 2006г)
В целом, возможно три принципа использования гонадотропинов для стимуляции суперовуляции:
- Фиксированный режим, подразумевает поддерживание постоянной дозой гонадотропинов в течение всего периода стимуляции. Считается, что удачно выбранная доза индуктора, не требующая коррекции вверх или вниз обеспечивает лучший прогноз лечения в пересчете на число качественных ооцитов, эмбрионов и частоту наступления клинической беременности. Несмотря на то, что это мнение не может пока считаться объективно проверенным, его все же придерживаются наибольшее число репродуктологов.
- Понижающий режим («шаг вниз/step down»), подразумевает высокую дозу индуктора овуляции на старте, с коррекцией вводимой дозы вниз, при необходимости. Такой режим стимуляции обеспечивает максимальный по численности и синхронности развития фолликулярный ответ за счет сверхвысоких концентраций ФСГ, что позволяет рекомендовать подход в группах пациенток сниженного фолликулярного резерва.
- Повышающий режим («шаг вверх/step up»), напротив, предполагает относительно низкие дозы гонадотропинов на старте протокола индукции, с возможностью значительного увеличения дозы в рамках скудного фолликулярного ответа. Данный подход обеспечивает максимальный контроль над когортой доминирующих фолликулов, следовательно- максимальные возможности для профилактики чрезмерного ответа и СГЯ. Недостатком понижающего режима является сокращение числа качественных, пригодных для оплодотворения ооцитов и увеличение количества фолликулов маленького диаметра на день назначения триггера овуляции.
Старт введения антагониста ГнРГ
Как известно, быстро развивающийся эффект после введения антагониста ГнРГ позволил избежать сколь-либо длительной подготовки к стимуляции яичников, приблизив по логике гормональных профилей ант-ГнРГ протокол к естественному циклу. Но важным вопросом тактики ведения такой индукции осталось объективное понимание и правильное определение начала подавления выработки гонадотропинов, с целью профилактики паразитарного пика ЛГ. С самого начала было постулировано, что теоретически и практически возможны два принципиально различных варианта:
- Гибкий протокол, с выбором дня первой инъекции антагониста ГнРГ по уровню эстрадиола (Frydman F и соавт., 1991г.) или/и среднему диаметру лидирующего фолликула (Olivennes и соавт., 2001)
- Фиксированный протокол, с назначением дня первой инъекции на определенный день индуцированного цикла, чаще 6-ой или 7-ой
В дальнейшем оба варианта ведения протоколов на антагонистах ГнРГ были протестированы в рамках сравнительных испытаний. Было отмечено, что несмотря на одинаковое количество необходимых визитов для ультразвукового мониторинга, пациентки, проходящие лечение по гибкому протоколу, нуждались в меньшем количестве инъекций антагониста ГнРГ и меньшей суммарной дозе гонадотропинов на цикл лечения. А количество зрелых ооцитов у них было статистически большим (11 ± 7 против 6 ± 4) (Ludwig M и соавт., 2002г).
Другими словами, адаптация протокола под индивидуальные особенности фолликулярного ответа в течение цикла индукции суперовуляции позволяет не только избежать ненужные инъекции (Olivennes F и соавт., 1995г.), но и оптимизировать реакцию яичников на стимуляцию вообще. К созвучным выводам пришли Al-Inany H, Aboulghar MA и соавт., 2005г, в проведенном позднее метаанализе. Автры отметили, что стимуляция суперовуляции в цикле ВРТ по гибкому протоколу сопровождается экономией в среднем 1 ампулы антагониста ГнРГ и почти 100Ме гонадотропинов, однако заметили, что задержка с введением первой инъекции антагониста ГнРГ, особенно позже 8-ого дня стимуляции, также окрашивается тенденцией к снижению частоты наступления беременности.
Применение препаратов комбинированной оральной контрацепции (КОК) для подготовки к циклу индукции
При сопоставлении циклов с применением антагонистов ГнРГ, начатых в спонтанном менструальном цикле или после отмены КОК было отмечено, что в группе КОК удалось
достичь лучшей синхронизации фолликулярной когорты с большим количеством доминирующих фолликулов и меньшей вариабельностью средних диаметров от фолликула к фолликулу, что потребовало увеличения средней продолжительности стимуляции яичников, с более поздним началом введения антагониста ГнРГ, так как искомого диаметра (в этой работе > 13 мм) фолликулы достигали значительно позже (Fanchin R и соавт., 2003г). Однако данные из другого исследования продемонстрировали соизмеримые показатели частоты наступления клинической беременности независимо от факта использования КОК перед протоколом ВРТ (Shapiro DB, 2003г.).
Следует отметить, что отдельной темой в этом вопросе идут пациентки с СПКЯ. Как известно, сразу в ряде исследований ранее был отмечен повреждающий эффект избыточных концентраций ЛГ у таких женщин (Chappel, Howles, 1991г; Shoham и соавт., 1993г). Считается, что ЛГ способствует запуску
- атрезии, путем накопления избыточных концентраций андрогенов
- преждевременного возобновления мейотического созревания ооцита
- лютеинизации гранулезных клеток и нарушения взаимодействия их с ооцитом, нарушения созревания ооцита
следовательно снижению качества ооцита, эмбриона и разбалансировки фолликулогенеза и трансформации эндометрия, снижению частоты наступления клинической беременности. Фактически действие ЛГ на созревающие фолликулы при СПКЯ схоже с действием ЛГ во время овуляторного пика (Willis и соавт., 1996г). Интересно еще и то, что влияние ЛГ на гранулезные клетки фолликула значительно усиливается при наличии гиперинсулинемии (Willis и соавт., 1996г), как известно свойственной женщинам с СПКЯ. Более того, тогда как гранулезные клетки обычно приобретают рецепторы к ЛГ и способны на него отвечать, при достижении фолликула 12-14 мм в диаметре, гранулезные клетки у ановуляторных женщин с СПКЯ способны гораздо раньше отвечают на ЛГ, при достижении фолликулом диаметра всего 4 мм (Willis и соавт., 1998г).
В этой связи логичным кажется предложение обсудить необходимость предварительной подготовки к циклу ВРТ, пациенток с СПКЯ не только препаратами группы синтетайзеров инсулина, но и КОК, так как последние достоверно способствуют снижению уровня ЛГ на момент начала нового менструального цикла, следовательно пагубного воздействия высоких концентраций эндогенного ЛГ.
Зависимость от ЛГ активности в период стимуляции суперовуляции
Фоновая ЛГ активность- объемная тема, объединяющая не только уточнение понимания последствий угнетения выработки эндогенного ЛГ, а также взвешивание целесообразности и количества дополнительных подколок препаратов с ЛГ активностью во время контролируемой индукции овуляции.
В рамках данной дискуссии, прежде всего, полезно вспомнить ряд клинических ситуаций, где ЛГ либо отсутствует, либо биологически неэффективен. В частности, при синдроме гипогонадотропного гипогонадизма пациентки хотя и находятся в состоянии хронической ановуляции, но развитие доминирующего фолликула можно стимулировать экзогенным введением гонадотропинов. Замечено, что введение таким пациенткам только очищенного или рФСГ хотя и обеспечивает мультифолликулярный ответ, но характеризуется непропорционально низкими концентрациями эстрадиола в плазме, снижению толщины эндометрия, частоты овуляции, оплодотворения, количества доступных для эмбриотрансфера или криоконсервировации эмбрионов, при сопоставлении с пациентками, получающими ЧМГ (Shoham и соавт., 1991г; Schoot и соавт., 1994г; Balasch и соавт., 1995г; Kousta и соавт., 1996г). При этом добавление эстрадиола в группе ФСГ не улучшало прогноз по вероятности наступления беременности (Hull и соавт., 1994г; Balasch и соавт., 1995г), что очевидно указывает на то, что основной дефект такой тактики реализуется не в нарушение качественных характеристик процессов пролиферации эндометрия, а именно в несостоятельность механизмов правильной подготовки зрелого ооцита. Другим показательным примером служат клинические случаи с первичной аменореей и бесплодием, обусловленные гомозиготной мутацией гена рецептора ЛГ. При этом так же регистрируются низкие концентрации эстрадиола, а при гистологическом исследовании яичников находят все стадии развития фолликула вплоть до больших антральных фолликулов (Latronico и соавт., 1996г; Toledo и соавт., 1996г).
В свете таких доводов уже не удивительно, почему необходимость присутствия лютеинизирующего гормона в период рекрутинга и развития доминирующего фолликула считается догмой репродуктивной эндокринологии (Fevold, 1941г; Short, 1962г), и поэтому исторически сложилось, что протоколы стимуляции яичников включали как ЛГ, так и ФСГ.
Однако непонятным по сей день остается вопрос комфортного количества ЛГ в плазме крови для обеспечения адекватного фолликулогенеза. Так, в публикации встречаются работы, где указывается, что всего Определение дня введения триггера овуляции
Успешный опыт применения длинного протокола «С» привил специфичные навыки ведения протоколов индукции. В частности клиническая мудрость: «Лучше чуть-чуть перетянуть, чем не дотянуть», служила зачастую руководством к действию в спорных ситуациях в определении дня введения триггера овуляции. Рождение новой логики протоколов ЭКО потребовало пересмотра многих тезисов, в чем-то да же изменение привычек давно практикующих врачей.
В общем-то не до конца адекватные способности антагонистов ГнРГ длительно удерживать паразитарный пик ЛГ задолго до научных умозаключений продемонстрировали несостоятельность упомянутой клинической мудрости и определили, время введения триггера финального созревания фолликула как критически значимый нюанс. Заставляя выбирать день для пункции фолликулов наиболее взвешено, раскладывая на одну чашку весов число зрелых ооцитов, а на другую грандиозно возрастающий с каждым дополнительным днем индукции рост риска выброса ЛГ.
К слову сказать, уже первое исследование, задуманное проверить эти рассуждения полностью подтвердило важность правильного выбора дня триггирования фолликулов с позиции эффективности лечения. В этом исследовании (Kolibianakis E и соавт., 2003г.) авторы вводили триггер овуляции на 17мм доминирующий фолликул или двумя днями позднее. При этом в группе более ранних пациентов отмечалась значимо большая частота успешности лечения. Здесь стоит повториться, что неизбежной платой использования антагониста ГнРГ в цикле лечения пока остается сокращение индукционной экспозиции когорты доминирующих фолликулов на 1-2 дня с целью оптимизации эффективности лечения с позиции частоты наступления беременности в свежем цикле. Что неизбежно реализуется в сокращение числа не только зрелых ооцитов, но что более важно, способных дать потенциально готовых для имплантации запасных эмбрионов, которые возможно будет использовать в криоцикле. Данная особенность протокола приобретает критическую значимость в клинических случаях с изначально ограниченным резервом доступных для индукции антральных фолликулов и ситуациях с исходно относительно низким качеством получаемых ооцитов, как например при эндометриозе. И практически не ощутима в группе высокоэффективных пациенток, например с трубно-перитонеальным фактором нарушения репродуктивной функции в высокофертильный репродуктивный возрастной период.
Замена ХГЧ агонистом ГнРГ
Детально рассматривая возможности антагонистов ГнРГ в обязательном порядке стоит упомянуть о дополнительных возможностях триггирования фолликулов, а именно о замене ХГЧ на агонист ГнРГ. Данный подход предполагает индукцию выброса собственного ЛГ- эффект всплеска. При формулировании этой концепции, предполагалось что тем самым цикл искусственной индукции фолликулярного роста вплотную приблизится по биохимическим процессам к естественному фолликулогенезу. Очевидно, что в раннюю бытность, когда балом правили агонисты ГнРГ такой алгоритм был не допустим в принципе.
За прошедшие годы накоплено большое количество обсуждений, затрагивающий этот момент индуцированного цикла. Выводы публикаций часто расходятся, но в целом в этом вопросе удалось сформулировать некоторые общие представления. Так, большинство исследователей сошлись во мнении, что практика использования агониста ГнРГ характеризуется снижением риска развития СГЯ средней и тяжелой степени, обеспечивая получение адекватного количества ооцитов хорошего качества, правда последнее замечание остается дискуссионным моментом, так как в других работах зафиксировано, что число зрелых ооцитов и эмбрионов хорошего качества в условиях триггирования агонистом, все же имеет тенденцию к сокращению. Еще более важный минус, выявленный в процессе широкой практики, который уже пожалуй обсуждается наиболее редко- это снижение частоты наступления клинической беременности (Griesinger G и соавт., 2006г.). Осознание этого факта не позволило внедрить поголовное использование агониста ГнРГ в качестве триггера овуляции в циклах под прикрытием антагониста ГнРГ, оставив за этим подходом лишь малый сегмент угрожаемых по СГЯ из общей массы пациенток, проходящих лечение методом ЭКО. Подразумевая при этом, что логика ведения таких пациенток предполагает этапный алгоритм, включающий не только замену триггера овуляции на агонист ГнРГ, получение ооцитов, но и последующую криоконсервацию развивающихся эмбрионов, с использованием их в крио-циклах конечного этапа. В своей работе Griesinger G и соавт., 2007г., продемонстрировали адекватность подобного подхода с хорошей кумулятивной частотой наступления беременности.
Останавливаясь более подробно на возможностях профилактики риска развития СГЯ у пациенток, проходящих индукцию суперовуляции с антагонистами ГнРГ, необходимо вспомнить ряд новаций. Так встречаются исследования, в которых авторы предлагают увеличивать дозу антагониста ГнРГ (de Jong D и соавт., 1998г), объясняя это тем, что более глубокое подавление выработки гонадотропинов, может быть более полезно с позиции снижения риска развития среднего и тяжелого СГЯ. В других работах авторы предлагают продолжать введение антагониста ГнРГ в течение длительного (до 7 дней) периода после введения триггера овуляции в циклах с последующей криоконсервацией эмбрионов. Однако такие подходы представляется спорным с позиции равновесия эффективность/стоимость, так как исключение риска прогрессирования СГЯ у пациенток в ант-ГнРГ протоколе практически гарантированно обеспечивается заменой триггера на агонист ГнРГ, обеспечивая уже само по себе адекватную профилактику риска среднего и тяжелого СГЯ, без увеличения стоимости и длительности цикла.
Поддержка лютеиновой фазы циклов с индукцией овуляции, прикрытых антагонистом ГнРГ
Осознание неполноценности второй фазы индуцированного цикла, с пониманием основных патологических механизмов, связанных с супрафизиологическими уровнями половых стероидов, в ответ на избыточную стимуляцию фолликулов, а также опосредованной через прямое действие препаратов для десенсетизации гипофиза и по принципу отрицательной обратной связи более резкое и ранее снижение уровней эстрадиола и прогестерона после переноса эмбрионов, побудило на практике рекомендовать поддерживающую гормональную терапию абсолютно каждой пациентке, проходящей лечение методом ЭКО. Появление в практике антагонистов ГнРГ, препаратов без длительного шлейфового эффекта на гипофизарную и яичниковую активность, сулило заманчивыми перспективами снижения необходимого объема поддерживающего гормонального лечения, в идеале с полным отказом от такового без потери эффективности цикла. Однако лечебная практика и здесь внесла свои коррективы, расставив все по своим местам. Уже совсем скоро всем стало ясно, что тезис, утверждающий об отсутствии глубокой неполноценности второй фазы индуцированного цикла при использовании антагонистов ГнРГ скорее маркетинговое, нежели клиническое утверждение. Дело в том, что антагонисты действительно не вызывают длительной супрессии гипофиза, следовательно не оказывают непосредственного негативного эффекта на функцию желтых тел, так как не вызывают длительного снижения выработки ЛГ после их отмены. Но, как оказалось, только лишь этого не достаточно, так как в среднюю лютеиновую фазу все равно происходит более ранее и скоротечное снижение активности желтых тел по механизму отрицательной обратной связи, вследствие ненормально высоких уровней половых стероидов в раннюю лютеиновую фазу индуцированного цикла. Проведенные в этом контексте исследования также подтвердили необходимость гормональной поддержки посттрансферного периода цикла индукции суперовуляции с использованием антагонистов ГнРГ (Albano C и соавт., 1998г, 1999г).
Альтернативные протоколы индукции овуляции с применением антагонистов ГнРГ.
Использование принципа практически сиюминутного запрета паразитарного пика ЛГ, без необходимости длительной предшествующей подготовки открыло широкие возможности модификации протоколов стимуляции овуляции. В этой связи было разработано и опробовано сразу несколько различных вариантов подготовки селективного фолликула или фолликулярной когорты, в зависимости от поставленной цели. В данной части будут рассмотрены наиболее часто используемые или зарекомендовавшие себя, как сравнительно надежные альтернативные подходы к стимуляции яичников.
- Модифицированный естественный цикл. Подразумевает вмешательство в естественный фолликулогенез с момента, когда рекрутируется единственный доминирующий фолликул, примерно, с условной середины фолликулярной фазы. С этого времени к терапии подключается антагонист ГнРГ с целью контроля над ЛГ- секреторной функцией гипофиза и гонадотропины в небольшой дозе, для поддержания фолликулярного роста, вплоть до дня введения триггера овуляции. Пилотное исследование данного подхода проведено Rongieres-Bertrand C, Olivennes F и соавт., 1999г. Авторы резюмировали, что несмотря на более частую отмену цикла из-за отсутствия возможности получения ооцитов, оплодотворения и доступности эмбрионов должного качества на эмбриотрансфер (в общем, 55%), получена сравнительно хорошая частота наступления беременности (15,9% на начатый цикл), особенно если учесть полное отсутствие такого грозного осложнения как синдром гиперстимуляции яичников. У этого протокола однако выявилась одна важная особенность. С увеличением возраста пациентки, в условиях снижения фолликулярного резерва, значительно увеличивается частота отмены цикла, в связи с преждевременной овуляцией. Суммация этого факта с зачастую не высоким качеством получаемых единичных ооцитов, не позволяет рекомендовать данный подход в качестве оптимального пациенткам со сниженным фолликулярным резервом.
- Модифицированный протокол с антагонистом ГнРГ. Представляет из себя лайт-версию классического протокола с антагонистом ГнРГ, где подключение гонадотропинов начинается не с непосредственного начала фолликулярной фазы (2 дня менструального цикла), а несколько позже, но не дожидаясь рекрутинга единственного доминирующего фолликула (4-6 дни естественного менструального цикла). Данный подход позволяет существенно сократить число доминирующих фолликулов в селекционной когорте, чем уменьшить риск развития среднего и тяжелого СГЯ в большинстве наблюдаемых случаев.
- Комбинированный протокол с применением кломифена цитрата, гонадотропинов и антагониста ГнРГ. Подразумевает минимальную стимуляцию яичников с начала фолликулярной фазы кломифен цитратом с дополнительным фоновым или последовательным введением гонадотропинов, под прикрытием антагонистом ГнРГ в момент потенциального риска пропуска паразитарного пика ЛГ. Протокол характеризуется незначительно большей эффективностью при сравнении с модифицированным естественным циклом в связи с негативным влиянием кломифен цитрата на пролиферирующий эндометрий и высокой частотой пропуска овуляторного всплеска ЛГ. В своем исследовании Engel J и соавт., 2002г, продемонстрировали следующие цифры: частота наступления беременности- 19,6%, частота паразитарных пиков ЛГ- 21,5%. В связи с этим в последнее время комбинированный протокол практикуется все реже. Между тем в литературе встречаются и примеры успешного использования комбинированного протокола в ЭКО- циклах. Так, Williams SC и соавт., 2002г, продемонстрировали высокую частоту наступления беременности (37%), практически сопоставимую с эффективностью длинного протокола (41%), при этом преждевременный всплеск ЛГ наблюдался только у 5% пациенток. Принимая во внимание диаметральную направленность полученных выводов, в условиях большого различия анализируемых протоколов, объективно пока можно сказать только, что комбинированный подход с использованием кломифена цитрата, гонадотропинов и антагониста ГнРГ имеет право на существование, но оптимальный протокол пока еще не разработан или как минимум является предметом дальнейших дискуссий.
- Другие сложные протоколы с применением антагонистов ГнРГ. Стремление к индивидуализации схем контролируемой индукции овуляции и широкие возможности к маневрам в рамках лечебного цикла, доставшиеся с внедрением антагонистов ГнРГ в широкую клиническую практику, позволили сформулировать большое количество концепций подготовки к пункции когорты преовуляторных фолликулов, самые сложные из которых включают, например, использование в одном лечебном цикле в доовуляторный день одновременно различные гонадотропины, агонист и антагонист ГнРГ, препараты КОК. Однако, данные подходы пока не зарекомендовали себя как более эффективные в сравнении с наиболее часто используемыми, поэтому не нашли широкого признания.
Низкий фолликулярный резерв
Постулирование тезиса о пагубном влиянии глубокой яичниковой супрессии на фолликулярный ответ на индукцию у пациенток со сниженным запасом антральных фолликулов, послужил отправной точкой для предположения, что применение антагонистов ГнРГ может стать идеальным выходом для пациенток с низким фолликулярным запасом, так как позволяет наиболее поздно вмешиваться в естественный фолликулогенез, подавлением эндогенных гонадотропинов, с целью блокады паразитарного пика ЛГ. Однако, до сих пор, нет достаточно аргументированных исследований, доказывающих эти предположения. Объективно говоря, протоколы на фоне антагонистов ГнРГ не могут считаться более эффективными в сравнении с другими используемыми на сегодняшний день протоколами индукции суперовуляции (Surrey ES и соавт., 2000г). Характеризуясь чуть лучшими показателями по числу полученных ооцитов, пригодных для оплодотворения, протоколы с антагонистами ГнРГ, имеют соизмеримую частоту наступления клинической беременности, даже при сопоставлении с коротким протоколом на агонистах ГнРГ (Griesinger G и соавт., 2006г).
Зависимость от массы тела
Известно, что ориентация в необходимой терапевтической дозе многих лекарственных препаратов производится по массе тела. Совершенно естественно, что после принятия минимальной терапевтической дозы исследовательские умы задались вопросом: «Какую роль в выборе оптимальной дозы может играть массы тела пациентки?». Ведь теоретически не удивительно, если окажется, что минимальная терапевтическая доза в 0,25мг в сутки может оказаться не адекватной для женщины с избытком массы тела и вместе с тем, излишней для женщины с дефицитом веса, тем более понимая, что между двумя этими женщинами довольной большая весовая разница и подходы к стимуляции, в частности потребность в гонадотропинах.
Проведенные исследования в отношении фармакокинетики цетрореликса показали, что препарат практически исчезает из плазмы крови и фолликулярной жидкости уже через несколько часов (Ludwig M и соавт., 2001г.), демонстрируя значения на границе чувствительности метода оценки. Однако проведенные клинические исследования, взвешивающие зависимость эффективности лечения от массы тела в рамках утвержденных дозировок не выявили корреляции (Engel J и соавт., 2002г).
Что касается ганиреликса, для этого лекарственного соединения была выявленная зависимость реальной эффективности от массы тела, и вынесена клиническая рекомендация о необходимости увеличения рекомендуемой дозы выше минимальной терапевтической, пациенткам с избытком массы тела.
Агонисты или Антагонисты?…Вот в чем вопрос!
Мощнейшее внедрение антагонистов в практику ВРТ началось на рубеже веков. Felberbaum R.E. и соавт., 2000г, одни из первых опубликовали объемные результаты своего опыта применения антагонистов ГнРГ (Цетротид в ежедневной дозе 0,25мг) в разных группах пациенток, проходящих лечение бесплодия в рамках технологии ЭКО. Проспективное многоцентровое исследование включало более 300 пациентов, дошедших до пункции фолликулов. Опираясь на статистически достойные достижения эффективности (доля ооцитов МII- 75%, частота оплодотворения- 59,2%, лечебный цикл завершился переносом эмбрионов в 92,2%, частота наступления клинической беременности на перенос эмбрионов- 23,6%), авторы фактически резюмировали, что данный подход ведения циклов ВРТ является не только допустимым, но и вполне приемлемым.
Однако практикующему врачу все же не достаточно знать, что препарат разрешен к использованию, ему важно понимать его реальную эффективность особенно по отношению к другим коммерчески доступным аналогам. Что же касается объективной полезности новых соединений, то ее можно было взвесить только в рамках прямого сравнения с имеющимися на данный момент лекарственными средствами. И логично, что в сравнении были сопоставлены новые протоколы с антагонистами ГнРГ и отработанные протоколы с агонистами ГнРГ, в частности с золотым стандартом подготовки доминирующих фолликулов, повсеместно распространенным длинным протоколом «С» на фоне агонистов ГнРГ.
Несмотря на скромный период времени с момента старта активного использования антагонистов ГнРГ в этом вопросе уже накопилось большое количество информации.
Важно отметить, что более ранние исследования (Ludwig M и соавт., 2001г.; Al-Inany H и соавт., 2002г.) пришли к похожим умозаключениям, основные из которых:
- Применение антагонистов ГнРГ обуславливает уменьшение длительности стимуляции яичников и суммарной дозы гонадотропинов на цикл лечения.
- Применение антагонистов ГнРГ сопряжено со статистически значимым снижением числа ооцит-кумулюсных комплексов и зрелых ооцитов.
- Применение антагонистов ГнРГ сопряжено со статистически значимым снижением эстрогении на день триггера.
- Применение антагонистов ГнРГ сопряжено со статистически значимым снижением частоты развития синдрома гиперстимуляции яичников (СГЯ), в особенности тяжелых его форм. Однако и здесь тезис оставался спорным, когда в прямом сопоставлении с длинным протоколом был ганиреликс.
- Применение антагонистов ГнРГ вероятно сопряжено с увеличением частоты пропусков паразитарного пика ЛГ.
- Применение антагонистов ГнРГ сопряжено со статистически значимым снижением частоты наступления беременности в сравнении с агонистами ГнРГ в длинном протоколе «С». Тезис особенно актуален для ганиреликса, и вероятно теряет вес, когда речь идет о цетрореликсе.
Между тем, большие, в том числе финансовые ожидания от новых препаратов не удовлетворились полученными довольно прямолинейными выводами, поэтому интерес к теме продолжал культивироваться и позднее реализовался в большое число исследований. Так очередной метаанализ (Kolibianakis EM и соавт., 2006г.), включал уже 22 опубликованных исследования (3176 пациентов). И к слову сказать, здесь уже не было отмечено существенной разницы в частоте наступления беременности, хотя этот метаанализ часто критикуют за необъективность, обусловленной слишком разношерстной подборкой исследований.
Между тем, очевидные преимущества нового протокола в части простоты применения и более высокой дружелюбности по отношению к пациентке, проходящей лечение, постепенно были оценены на практическом этапе и выделили свой сегмент из общей популяции пациенток, приходящих в протокол ЭКО пациенток. Так в публикациях можно встретить, что протоколы с антагонистами ГнРГ составляют от 40% до 90% всех циклов ЭКО отдельных центров репродукции. В этой связи появились публикации уже последовательной оценки общей эффективности лечения до и после внедрения антагонистов ГнРГ в практику. Ludwig M и соавт., 2000г.; Samama M и соавт., 2002г., продемонстрировали, хорошие результаты двух сравниваемых протоколов ведения циклов ВРТ. Безусловно, выводы, полученные из такого оценочного подхода не могут считаться методологически безупречными, но они все же указывают на то, что применение антагонистов ГнРГ в группе ожидаемы высоко эффективных пациенток логично и может пропагандироваться, как оптимальный стандарт.
Таблица сравнительной оценки характеристик двух различных подходов десенситизации гипофиза.
| Сравнительная характеристика | агонист ГнРГ | антагонист ГнРГ |
| Стоимость | выше | ниже |
| Дружелюбность по отношению к пациентке | ниже | выше |
| Общее число инъекций на цикл лечения | выше | ниже |
| Потребность в гонадотропинах | выше | ниже |
| Синдром гормональной отмены | возможен | отсутствует |
| Приемлемость в условиях высокого фолликулярного резерва | ниже | выше |
| Приемлемость в условиях низкого фолликулярного резерва | объективно не определена | объективно не определена |
| Программируемость цикла лечения | выше | ниже |
| Количество ооцитов MII | выше | ниже |
| Риск паразитарного пика ЛГ | ниже | выше |
| Уровень эстрогенной насыщенности | выше | ниже |
| Риск СГЯ | выше | ниже, однако для ганиреликса объективно не доказано |
| Частота наступления беременности | выше | ниже |
Когда речь не идет о жизни пациента медицинская наука в большей степени взвешивает другие важные нюансы лечения, будь то качество жизни, дружелюбность медицинских действий с позиции восприятия этапов лечения пациентом, тем самым по настоящему поворачиваясь к субъекту лицом, воспринимая его не как пациента-единицу, а индивидуума. Несмотря на очень успешный опыт ведения протоколов ВРТ с применением агонистов ГнРГ, репродуктологами практически сразу была отмечена костность длинного протокола, с довольно узким коридором индивидуализации под конкретного пациента. Мобильность медицинской науки в части применения вспомогательных репродуктивных технологий позволяет не только теоретически дискутировать о потенциальных возможностях того или иного подхода к ведению пациента, но и апробировать логические теоретические изыскания в практике. И здесь практика применения антагонистов ГнРГ продемонстрировала большие и, что важно новые возможности в индивидуализации лечебного подхода к пациенту, нуждающемуся в стимуляции овуляции. В целом, как развитие кинематогрофа не только не уничтожило театр, а превратило его в еще более камерное явление, разделив общую популяцию людей на тех, кто хочет смотреть и тех, кому необходимо соучаствовать, так и появление антагонистов не только не вытеснило агонисты ГнРГ из ежедневной рекомендации репродуктолога, а очертило для них свою нишу, позволив оставить за длинным протоколом «С» на агонистах ГнРГ только действительно оптимальную группу пациенток. Что в общегалактических объемах помогает достигнуть цели (справиться с бесплодием) не только более эффективным, но и легким и коротким путем.
Здоровье матери и ребенка
Конечным результатом проведенного лечения методами ВРТ в клинической репродукции человека принято считать даже не зачатие и процент наступления беременности, а рождение здорового ребенка. Совершенно естественно, что оценка любой рекомендации, в том числе и фармакологической в конечном счете производится с позиции не только эффективности, но и безопасности для пациентки и плода, а впоследствии матери и ребенка. К счастью, здесь оказалось без неожиданностей и для обоих антагонистов ГнРГ, широко используемых в повседневной практике не было выявлено какого либо негативного эффекта на здоровье матери и ребенка (Ludwig M и соавт., 2001г; Olivennes F и соавт., 2001г; Boerrigter PJ и соавт., 2002г; Kiminami A и соавт., 2003г).
Антагонисты ГнРГ- особая группа лекарственных соединений, идея о необходимости в которой родилась задолго до появления удобных и безопасных в повседневном использовании препаратов. И несмотря на то, что самих лекарственных препаратов уже довольно долгие годы так и остается всего два, практическая потребность в них просто поражает.
В целом, как и предполагалось, появление антагонистов ГнРГ совершило маленькую революцию в узком круге репродуктивной медицины. Использование этих веществ позволило по настоящему заговорить об индивидуализации лечения, рассматривая врачом и предлагая пациенту различные по своей сути подходы в таком важном этапе экстракорпорального оплодотворения, как стимуляция суперовуляции. Позволяя использовать возможности не только индивидуализации дозы и режима введения препаратов, но выдвигая альтернативные подходы к контролируемой индукции овуляции, более широкие возможности в разных группах пациенток, в частности с потенциальным риском и свершившимся фактом избыточного фолликулярного ответа. При этом понятность и простота логики ведения циклов с антагонистами ГнРГ стала приятным бонусом для восприятия их врачом и пациентом.
В этой связи уже кажется ни кто не замечает, что новая тактика стимуляции характеризуется и неоправдавшимися надеждами. В частности применение протоколов с антагонистами ГнРГ все же характеризуется повышением риска пропуска паразитарного пика ЛГ, появляется тенденция к снижению частоты наступления беременности, следовательно возникает необходимость более раннего снятия пациентки с цикла ВРТ, введением триггера овуляции, что сопровождается снижением числа зрелых ооцитов, эмбрионов, а значит и потенциальных возможностей в будущих криоциклах в случае неудачи.
Мы просто продолжаем учиться работать с этими препаратами, в частности соглашаемся с важными нюансами, например, что Цетотид более приемлем чем Оргалутран в группе пациенток, угрожаемых по СГЯ, а гибкий подход при определении старта подавления антагонистом ГнРГ гораздо более приемлем, чем фиксированный, но пошив не следует начинать слишком поздно, во всяком случае позднее 8-го дня индукции. Мы пытаемся объективно взвесить индивидуальную потребность в экзогенном ЛГ, при этом понимая, что препараты этой линии совершенно точно не полезны поголовно всем пациенткам, проходящим циклы ЭКО. Кроме того, мы наконец догадались, что бессмысленно в общем сравнивать агонисты и антагонисты ГнРГ, нужно просто научиться понимать, кому из пациенток какой протокол подходит лучше. Сейчас всерьез можно говорить, что антагонисты ГнРГ научили нас индивидуальному подходу к частому клиническому случаю. И в этом их самая главная заслуга.
источник